白癜风样小鼠皮肤脱色模型研究进展与思考
【摘要】 白癜风的病因及发病机制均未明确,动物模型是白癜风研究的重要工具。除传统的白癜风小鼠模型外,许多新模型逐渐建立,如表达表皮黑素细胞、黑素细胞反应性T细胞的小鼠模型、K14⁃SCF/h3TA2/HLA⁃A2三转基因(Vitesse鼠)小鼠模型、自身免疫诱导的小鼠模型、化学试剂诱导的小鼠模型等,这些模型与人白癜风高度相似,在可重复性和稳定性等方面都有不同程度提高,已成为研究白癜风发病机制、探索治疗靶点和评判疗效的良好模型。本文综述目前白癜风样小鼠脱色模型的研究进展,并分析存在的问题。
【关键词】 白癜风;黑素细胞;疾病模型,动物
基金项目:国家自然科学基金(81872521、82173414);空军军医大学凌云工程翱翔计划项目(Axjhjz⁃102)
DOI:10.35541/cjd.20220072
Research progress and thinking in mouse models of vitiligo⁃like depigmentation
Jian Zhe, Zhang Jia
Department of Dermatology, Xijing Hospital, The Fourth Military Medical University, Xi′an 710032, China Corresponding author: Zhang Jia, Email: 362014063@qq.com
【Abstract】The etiology and pathogenesis of vitiligo have not yet been clear, and animal models are important tools for vitiligo research. In addition to traditional mouse models of vitiligo, many new models have been gradually established with the deepening of research, such as mouse models expressing epidermal melanocytes and melanocyte⁃reactive T cells, K14⁃SCF/h3TA2/HLA⁃A2 triple⁃transgenic mouse (Vitesse mice) models, autoimmune ⁃induced mouse models, chemical reagent ⁃induced mouse models, etc. Manifestations of these models are highly similar to human vitiligo, their reproducibility and stability have been improved to different extents, and they have already become good models for exploring the pathogenesis of and therapeutic targets for vitiligo,as well as for evaluating therapeutic efficacy. This review summarizes current research progress and existing problems in mouse models of vitiligo ⁃ like depigmentation.
【Key words】 Vitiligo; Melanocytes; Disease models, animal
Fund programs: National Natural Science Foundation of China(81872521, 82173414); Aoxiang
Program in Lingyun Project of Air Force Military Medical University(Axjhjz⁃102)
DOI: 10.35541/cjd.20220072
白癜风是一种以皮肤黏膜色素脱失为特征表 现的获得性自身免疫性皮肤病,病因和发病机制均不明确,亦无特效治疗方法[1]。可靠的动物模型是 研究其发病机制和治疗方法的关键,而实验动物的选择则是动物模型成功建立的基础。相比于以大鼠、豚鼠、Smyth line(SL)鸡、家兔、犬、马、水牛等为基础制备的白癜风样动物模型,白癜风样小鼠模型具有种类多、体型小、生长周期短、饲养方便、繁殖力强、易于控制等特点,同时许多白癜风样小鼠模型的皮损特点与人类白癜风皮损相似。现分析比较各白癜风样小鼠皮肤脱色模型研究进展及特点。
一、常见白癜风样小鼠皮肤脱色模型研究现状目前已建立的白癜风样小鼠皮肤脱色模型主 要有化学试剂诱导的小鼠模型、自身免疫诱导的小 鼠模型和转基因小鼠模型。
(一)化学试剂诱导的白癜风样小鼠皮肤脱色模型
1. 杜鹃醇(rhododenol)诱导的小鼠模型:杜鹃醇是一种天然酚类化合物,作为酪氨酸酶抑制剂被日本开发用于美白护肤品中,然而该护肤品上市5年后,约2%的使用者面部出现白癜风样表现,虽然部分可自发性复色,但仍有27%的患者白斑未见缓解,部分甚至症状加重,故又称为杜鹃醇型白皮症[2⁃3]。因此,有研究者将杜鹃醇作为诱导小鼠产生白斑的试剂[3]。他们将表达人角蛋白14(human keratin 14,hk14)⁃干细胞因子(stem cell factor,SCF)的转基因小鼠与相同背景的无毛小鼠杂交,获得表皮有黑素细胞且类似于日本人肤色的小鼠[3⁃4],在该小鼠背部连续涂抹30%的杜鹃醇7 d后观察到轻微脱色,14 d时脱色明显,于28d停用,观察白斑复色情况。在停用杜鹃醇42d后,可观察到皮损复色,但仍有少量白色斑点。对白斑进行组化、生化和电镜分析观察显示,从第7天开始,表皮黑素细胞逐渐消失,局部产生有毒代谢物杜鹃醇醌[3]。研究者发现,杜鹃醇处理激活了小鼠黑素细胞内质网应激,导致酪氨酸酶依赖的杜鹃醇代谢产物累积并损伤黑素细胞[3,5]。在组织病理学上观察到4种特征改变,即真表皮交界处空泡样变、真皮乳头层噬黑素细胞、淋巴细胞浸润和基底层黑素丢失或减少;电镜观察发现色素减退处尚残存少量黑素细胞,但黑素细胞中已出现空泡化的黑素小体[2,6⁃7]。
该模型起初用于研究含杜鹃醇的化妆品诱导的白斑发生机制,但由于杜鹃醇可干扰黑素合成,同时又不影响黑素细胞完整性,因此黑素细胞会逐渐恢复功能[3]。所以,此模型可用于研究白癜风复色机制。然而该模型诱导出白癜风样皮损的成功率有限,其稳定性如何亦需进一步观察。
2.莫诺苯宗(氢醌单苯醚)诱导的小鼠模型:莫诺苯宗诱导的白癜风模型最初由Zhu等[8] 构建,通过在4周龄雌性SPF级C57BL/6小鼠局部(剃毛后的腹部)局部外用40%莫诺苯宗乳膏,可在涂抹处与非涂抹处诱导出白癜风样表现。研究发现,莫诺苯宗能迅速抑制小鼠黑素瘤生长,并诱导出黑素细胞抗原特异性免疫反应[9];同时,莫诺苯宗可诱导醌与酪氨酸酶形成新的抗原(醌-半抗原),进而提高黑素细胞的免疫原性[10];此外,莫诺苯宗还可能通过诱导黑素小体自噬及酪氨酸酶泛素化增强促黑素细胞分化抗原的递呈,从而进一步诱发针对黑素细胞的免疫反应[11⁃12]。与人白癜风皮损类似,莫诺苯宗引起的色素脱失同样表现为皮损中黑素细胞缺失和 CD8+ T 细胞浸润[8]。敲除小鼠成熟T淋巴细胞生成的关键基因即可阻断莫诺苯宗诱导的远距离脱色,这支持 CD8+ T 细胞参与莫诺苯宗诱导的黑素细胞破坏[13]。
该模型模拟了人白癜风中CD8+ T细胞参与疾病发生发展的机制,莫诺苯宗诱导的白斑与患者的色素脱失在组织学特征和发病机制上存在高度相似[7⁃8,14],说明该模型在研究白癜风发病机制和治疗等方面均具较好的应用价值[15]。在莫诺苯宗诱导的小鼠脱色模型的基础上,祝逸平等[16] 研究针刺对小鼠脱色的影响,揭示局部皮肤屏障破坏可以促进莫诺苯宗诱导的白癜风小鼠背部脱色。李情等[17]通过比较茶多酚、吡美莫司、他克莫司外用的疗效,验证了药物治疗的效果。但是,该模型选择表皮不含黑素细胞的C57小鼠,在一定程度上限制了其应用;此外停止涂抹莫诺苯宗后该模型复色较快,因此其稳定性还需进一步优化。
(二)自身免疫诱导的白癜风小鼠模型
1. 黑素瘤免疫治疗过继转移小鼠模型:为研究黑素瘤消退的生物学机制,Steven等[13,18 ⁃ 19]在C57BL/6背景下培育了一种名为“Pmel⁃1”的转基因鼠,由于Pmel⁃1表达T细胞受体Vα1Vβ13,可特异性识别 H⁃2Db 限制性表位,该表位对应 gp100的 25⁃33 氨基酸。将 Pmel⁃1 转基因鼠的CD8+ T细胞过继转移到淋巴细胞耗竭的荷瘤小鼠(B16)体内,随后注射表达人同源基因 gp100 的重组鸡痘病毒(recombinant fowelpox virus ⁃ human gp100,rFPV ⁃hgp100)刺激产生gp100特异性T细胞,同时联合使用白细胞介素2(interleukin⁃2,IL⁃2)、IL⁃5等T细胞生长因子增强免疫反应[13,20]。3 d后肿瘤开始逐渐消退,并在消退部位出现白癜风样表现,这种白斑通常会在小鼠的整个皮毛上随机扩散,类似表现在接受免疫治疗的黑素瘤患者中也时常见到[18]
但由于此模型对小鼠健康状况及饲养环境要求颇高,加之C57BL/6小鼠的皮肤呈粉红色且大多数黑素细胞位于毛囊内而非表皮内,因此该模型只能显示毛发脱色,与人白癜风表型不太一致[21]。此外,该模型也不能真实反映人白癜风自身免疫性CD8+ T细胞的激活机制,故尚需进一步完善。
2. 过继转移 Pmel ⁃ 1 细胞的 SCF 小鼠模型:Harris等[21] 构建了一种依赖亚致死量辐照、过继转移 Pmel⁃1 细胞和表达人同源基因gp100的重组牛痘病毒(recombinant vaccinia virus ⁃ human gp100,rVV⁃hgp100)感染从而激活体内Pmel⁃1细胞的白癜
风小鼠模型。该模型由黑素瘤免疫治疗过继转移模型改良而来,其选择使用SCF转基因鼠为母本,该小鼠表皮保留有黑素细胞[21,13]。基于该小鼠诱 导的白癜风出现了表皮脱色而毛囊黑素细胞保留的现象,这与人白癜风极其类似,且该模型能模仿毛囊周围复色等人白癜风复色模式。研究者从Pmel⁃1 T 细胞(抗原)受体(T cell receptor,TCR)转基因鼠脾脏中获得经阴性选择后的Pmel⁃1细胞,将其过继转移到移植前1天使用亚致死剂量(5Gy)γ射线辐射的 SCF 鼠体内,并在移植当天注射 rVV⁃hgp100 以增强免疫反应,由于 Pmel⁃1特异性TCR转基因鼠 CD8+ T 细胞识别小鼠和人Pmel-1 蛋白(也称gp100,一种黑素细胞特异性分化抗原),因此可诱导表皮色素脱失[19,21]。该模型鼠首先在足垫和尾巴上出现点状色素脱失斑,严重时耳朵和鼻子上也会出现,起初白斑呈局限性“补丁状”,并逐渐
扩大,但毛发均未受累。通常在诱导后第3周开始出现色素脱失,白斑在7周内逐渐增加,随后到达稳定期,之后通常不会再继续发展。流式细胞仪检测发现,自身反应性 CD8+ T 细胞在皮损处浸润并在第 5 周达到高峰,荧光显微镜观察发现,CD8+ T细胞在色素沉着部位呈簇状分布,并可见到补丁样色素脱失现象。
该模型成功的关键是使用表皮内含有黑素细胞的SCF转基因鼠,其黑素细胞发育、迁移和生存依赖kit蛋白(配体即SCF)的表达,可趋化招募黑素细胞于毛囊间上皮中[22⁃25]。
该模型具有以下特点:①选用表皮存在黑素细胞的SCF转基因鼠,使皮肤和毛发变黑,因此该模型色素脱失后毛囊仍保留有黑素细胞,可模拟类似于人的毛囊复色现象;②该模型色素脱失主要发生在表皮内,与人白癜风脱色模式类似;③组织病理显示,白斑出现前有黑素细
胞减少及自身反应性 CD8+ T 细胞聚集现象,与人白癜风活动期的皮损类似;④在色素脱失的同时,皮损中出现自身反应性 CD8+ T 细胞浸润、酪氨酸酶表达降低及局部 γ 干扰素(IFN⁃γ)产生,且中和IFN⁃γ可防止CD8+ T细胞聚集与色素脱失,提示此模型可用于白癜风治疗的观察;⑤该模型稳定性较好,但由于是通过 Pmel⁃1 CD8+ T 细胞过继转移并激活而诱发白癜风,故此模型不适合研究如氧化应激等其他发病机制;同时,因SCF鼠在遗传上不易自发产生白癜风,故也不适合研究外部环境因素的影响;⑥该模型可协助用于研究Pmel⁃1、CD8+ T细胞介导的其他疾病的先天性免疫途径,但不一定适合研究参与白癜风发病的先天免疫途径[21];⑦由于未对该模型白癜风皮损持久性和稳定性做出评价,其长期稳定性如何尚需进一步观察;⑧最后,准确、迅速、稳定的操作技术,以及对Pmel⁃1细胞注射数
量与合适的rVV⁃hgp100病毒滴度的把控也是成功造模的关键,这也给操作者提出了更高的要求。
3. 黑素瘤-调节性 T 细胞(regulatory T cells,Treg)诱导的白癜风样小鼠模型:由于人白癜风发病由多种识别不同黑素细胞特异性抗原的CD8+ T细胞驱动,而黑素瘤免疫治疗可激活 CD8+ T 细胞来识别这些黑素瘤和黑素细胞共有抗原,因此临床上接受免疫治疗的黑素瘤患者中13.5% ~25.7%发生白癜风[26⁃28]。此外,Treg细胞的缺失可诱导自身免疫CD8+ T细胞活化,导致白癜风发生。使用CD4抗体耗竭 CD4+ CD25+ Treg 细胞后不会对 B16 原发 肿瘤的生长产生显著影响[29]。基于此,北京生命科学研究所陈婷团队在前人基础上建立了一种黑素瘤⁃ Treg 诱导的白癜风小鼠模型[30]。他们采用B16F10黑素瘤细胞接种联合Treg细胞缺失来激活内源性自体反应性CD8+ T细胞靶向杀伤表皮黑素细胞,诱导白癜风发生,大致步骤为:先在8 ~ 9周龄 C57BL/6 小 鼠 右 侧 背 部 皮 内 接 种 2 × 105 个B16F10黑素瘤细胞,分别于第4、10天注射CD4抗体,于第12天行手术切除原发肿瘤,由于小鼠皮肤表皮更替时间为30d[31],于第 30 天左右在肿瘤切除部位逐渐出现白发,45天左右小鼠尾部皮肤出现肉眼可见白斑。C57BL/6 小鼠背部皮肤的黑素细胞位于毛囊而非表皮,而小鼠尾部皮肤的黑素细胞具有与人皮肤相似的特点,位于毛囊和表皮内,因此该模型使用小鼠尾部皮肤进行观察分析。观察发现,诱导后30 d表皮黑素细胞丢失达到高峰,诱导后60 d色素脱失进一步明显。小鼠尾部皮肤表皮色素脱失起初呈斑片状并逐渐发展,最终覆盖整个表皮,连续观察1年多后仍未复色,且未发现红肿或表皮鳞屑等皮肤炎症反应。
该模型的优点是:造模周期较短,操作方法相对简单,可重复性强,依靠激活小鼠自身CD8+ T细胞实现,造模效果好、白斑稳定。缺点是:因C57BL/6小鼠表皮无黑素细胞,白斑的主要观察部位为鼠尾和毛囊,而在鼠尾进行外用药物研究会因尾部表皮鳞片透皮性差等原因产生一定局限性;其次该模型对B16F10及CD4+ T细胞抗体质量要求颇高,对操作者的技术亦有较高要求,注射深度和药量等因素都会对最终的成模效果产生影响;此外该模型中Treg细胞最初是耗竭的,未来使用该模型研究Treg等CD4+ T 细胞在驱动白癜风发生进展中的作用时应考虑到这些因素。
(三)转基因小鼠模型
1. FH 转基因小鼠:Gregg 等[32]和 Nichols 等[33]在 AAD+(主要组织相容性Ⅰ类重组分子,含有人HLA⁃A*0201的多肽结合区,与小鼠H⁃2Dd的CD8结合域相连)白化小鼠基础上构建趋化因子受体和效应分子缺陷的FH小鼠,在该小鼠出生后24 h内和7 d后分别注射100 mg抗CD4抗体、抗CD8抗体 和抗 CD25 抗体,以清除体内CD4+、CD8+和CD25+ T细胞,再通过磁珠从脾脏和淋巴结中分选出IFN⁃γ+/+ 和IFN⁃γ-/- FH CD8+ T细胞,将纯化的
CD8+ T细胞尾静脉注射入亚致死剂量辐照的AAD+ 非转基因C57BL/6鼠体内,随后隔日注射白细胞介素2(IL⁃2)连续10 d,最终构建成白癜风小鼠模型。该模型能识别酪氨酸酶抗原表位,所有表达FH基因的AAD+ 酪氨酸酶阳性鼠都出现表皮和毛囊的进行性脱色。造模结果显示,小鼠产后3 d双耳出现均一的色素脱失斑,5 d眼周形成色素脱失环,随后口鼻部也开始出现白斑。产后21 d时尾部出现色素脱失并逐渐扩大,在小鼠7周龄时色素脱失部位出现斑点状复色,颜色先变灰后又再次出现色素脱失,此后白斑稳定存在,并逐渐扩大累及全身,但并非所有色素脱失的小鼠均有这种现象;在20 ~ 21周龄时,色素脱失停止进展并趋于稳定。
该小鼠模型皮损发生部位、白斑进展过程及其免疫学机制与人白癜风高度相似,且均为自发性产生而无性别差异,白斑的发生发展对IFN⁃γ和CXC趋化因子受体3依赖性强,其表达降低可使皮损部位 CD8+ T 细胞浸润减少。因此,适合研究细胞因子及相关免疫通路在白癜风中的作用。但该小鼠模型存在如造模复杂、色素脱失不稳定、白斑发展受年龄因素影响等局限性。
2. TCR 转基因自发性表皮脱色小鼠(Vitesse鼠):为构建自发性表皮脱色小鼠模型,Jonathan等[34⁃35] 首先构建了可在4周龄开始自发性毛发脱色的h3TA2鼠。该小鼠由于使用了来自人黑素细胞和黑素瘤反应性CD+ T细胞的转基因TCR,该TCR可识别酪氨酸酶,因此保留了针对表皮黑素细胞的自身免疫应答。这种高亲和力的 TCR 对 CD8 +、CD4+ 和双阴性T细胞均发生反应,与人类白细胞抗原A2(human leukocyte antigen⁃A2,HLA⁃A
2)转基因一起表达构建h3TA2小鼠[36]。接下来,构建表皮内具有黑素细胞的K14⁃SCF转基因鼠,其角质形成细胞表达的膜结合SCF可保留表皮黑素细胞,导致皮肤色素沉着,并限制肥大细胞浸润[4]。最后,他们将h3TA2鼠与K14⁃SCF鼠杂交,得到表皮具有黑素细胞和黑素细胞反应性T细胞及表达主要组织相容性相关抗原的 K14⁃SCF/h3TA2/HLA⁃A2因小鼠(Vitesse鼠)[34]。该模型表现为自发性表皮色素脱失,通过观察发现Vitesse 鼠在14周龄时出现类似人白癜风的对称性、边界清楚和完全脱色的白斑(不同于在h3TA2鼠中观察到的毛发变白),比h3TA2鼠表现出更快、更完全的色素脱失。
Vitesse鼠的快速脱色过程与其丰富的黑素细胞以及IL⁃17反应增强相关,该模型结合了T细胞介导的针对表皮黑素细胞的自身免疫反应和部分皮损重新复色的特点,与人白癜风较为相似,为研究T细胞亚群在白癜风中的作用提供了良好的模型,也为研究白癜风发生发展和治疗提供了有力的工具。同时,Vitesse鼠白斑重新复色的特点使其适用于观察白癜风局部治疗的效果,如观察局部药物或光疗等的疗效。但也存在以下问题:①在Vitess鼠白斑分离出的 T 细胞中,> 15% 会与gp100反应,理论上会影响小鼠对其他抗原的反应[37];②人白癜风中可能同时存在数种抗原,而该模型中T细胞主要针对酪氨酸酶相关抗原;③小鼠丰富的毛囊可提供较多的黑素干细胞,因此高复色率也将影响白斑的稳定性。总体来说,Vitesse 鼠为研究局部药物或光疗等手段在白癜风治疗中的作用提供了良好的模型。
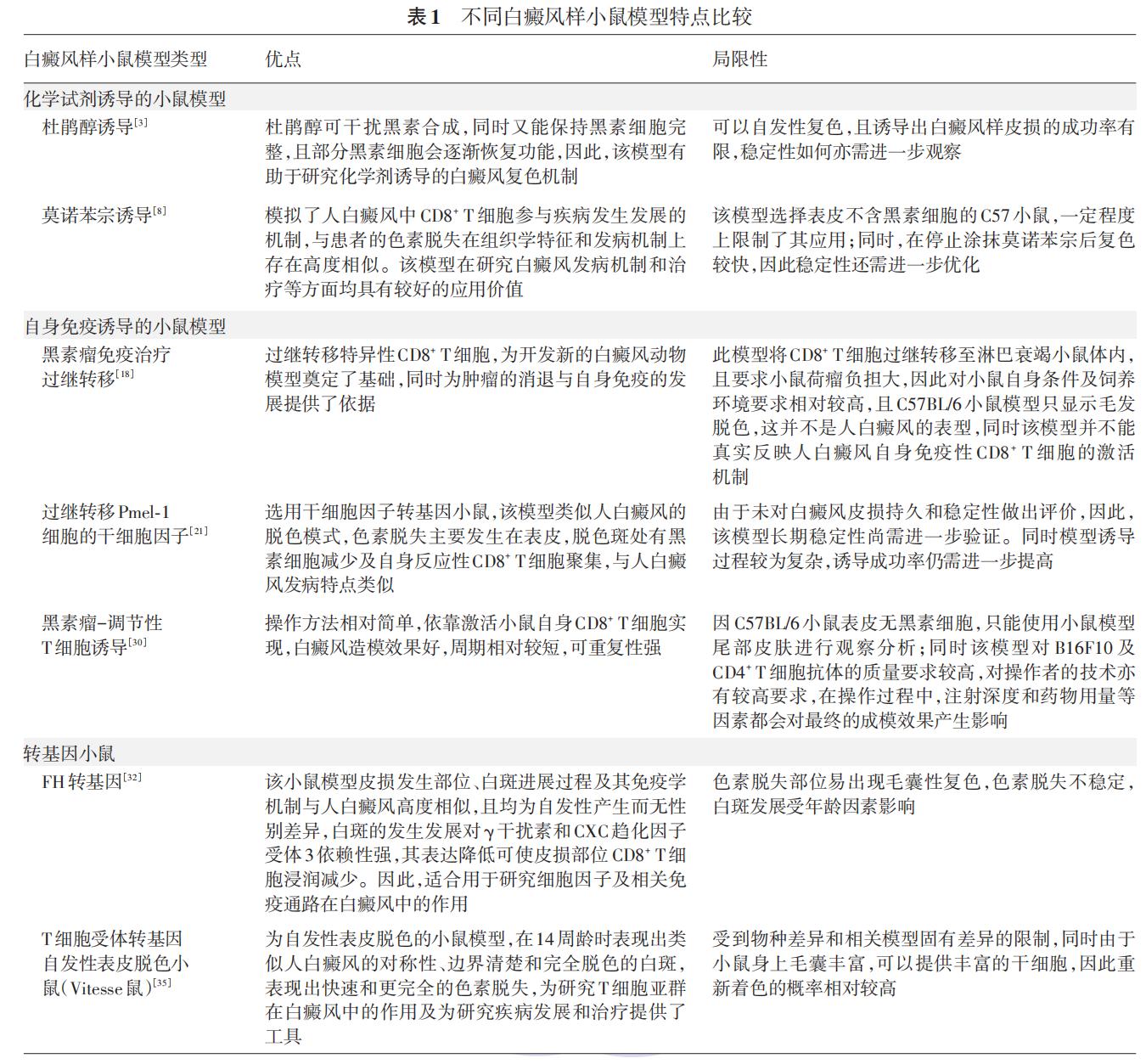
上述各类白癜风样小鼠模型特点总结见表1。
二、本课题组关于白癜风小鼠模型的探索目前本课题组多采用陈婷团队的黑素瘤⁃Treg
方案诱导构建白癜风模型。但在该模型构建中我们发现,其对B16F10细胞及CD4+ T细胞耗竭抗体的活性状态要求很高,同时操作者要经过严格的培训才能掌握该技术;此外,该模型使用的是普通C57BL/6 小鼠,其毛发变白并不适合白癜风的研究,而以鼠尾白斑进行实验观察时又存在样品有限、干预方式困难等局限性。因此,为了构建更优的白癜风小鼠模型,本课题组目前正在建立并优化以下两种模型。第一,过继转移Pmel⁃1细胞的SCF小鼠模型,即通过SCF转基因小鼠眶后注射的方式过继转移Pmel⁃1 细胞,并使用 rVV⁃hgp100重组病毒激活转移的CD8+ T细胞而诱发产生白斑[38]。该模型稳定性好,与人白癜风发病特点类似。在模型制备中,我们发现:①要严格把控辐照剂量,在Harris课题组采用γ射线总剂量5 Gy辐照1次基础上,通过调整适宜辐照剂量、延长辐照时间、降低辐照率,探索出符合国内使用要求及实验室特点的辐照方案;②因辐照一定程度上破坏了小鼠的免疫系统, 在实验及转运过程中应尽可能避免不必要的暴露和污染,以免对实验结果产生影响,甚至引起实验动物的死亡;③该造模方法使用的是表皮及毛囊均有黑素细胞的SCF小鼠,尾部呈黑色,尾静脉显示不清,因此常使用眶后注射来过继转移CD8+ T细胞,操作过程中易出现CD8+ T细胞状态差、过继转移量不足、小鼠损伤、重组病毒活性降低等问题,要求操作者在操作过程中要迅速而准确,这些均是制约造模成功与否的关键。第二,莫诺苯宗诱导SCF 鼠白癜风样模型。我们在 SCF 转基因鼠背部涂抹 40%莫诺苯宗,10 d 后于涂抹部位观察到白
斑,随着涂抹时间的延长,白斑进一步加重,取皮损周围皮肤进行Melan⁃A染色,可见黑素细胞明显减少。在该模型的制备中,我们发现:①制备前期脱色不稳定,需要连续涂抹莫诺苯宗,否则很容易发生复色;②该模型诱发脱色快,方法简单,适用于疾病治疗的研究。
三、目前存在的问题及思考
目前白癜风的病因和发病机制仍不清楚,很难复制出合适的动物模型[39],限制了白癜风等色素脱失性皮肤病的基础研究。单病因素、化学试剂诱导的白癜风模型和多病因复合因素、转基因诱导的白癜风小鼠模型各具特点,但这些模型制备的重复性和专一性尚需进一步论证。如何对造模小鼠进行评价,如何统一制备标准等问题都需要在白癜风小鼠模型的推广使用中加以解决和完善。
最后笔者认为,建立可靠的小鼠模型是白癜风基础研究的关键,我们要立足现有模型,对国际公认的较成熟的模型进行深入探索,使该模型标准化,在保证稳定性的同时,增强其可重复性。在此基础上,时刻关注白癜风研究领域的最新动态,适时合理地应用到白癜风造模中,最终服务于各类色素性皮肤病的研究。
参 考 文 献
[1] Ezzedine K, Eleftheriadou V, Whitton M, et al. Vitiligo[J].Lancet, 2015,386(9988):74⁃84. doi: 10.1016/S0140⁃6736(14)60763⁃7.
[2] Tokura Y, Fujiyama T, Ikeya S, et al. Biochemical, cytological,and immunological mechanisms of rhododendrol ⁃ inducedleukoderma[J]. J Dermatol Sci, 2015,77(3):146 ⁃ 149. doi: 10.1016/j.jdermsci.2015.02.001.
[3] Abe Y, Okamura K, Kawaguchi M, et al. Rhododenol ⁃ inducedleukoderma in a mouse model mimicking Japanese skin[J]. JDermatol Sci, 2016,81(1):35⁃43. doi: 10.1016/j.jdermsci.2015.10.011.
[4] Kunisada T, Lu SZ, Yoshida H, et al. Murine cutaneousmastocytosis and epidermal melanocytosis induced bykeratinocyte expression of transgenic stem cell factor[J]. J ExpMed, 1998,187(10):1565⁃1573. doi: 10.1084/jem.187.10.1565.
[5] Ito S, Okura M, Nakanishi Y, et al. Tyrosinase ⁃ catalyzedmetabolism of rhododendrol (RD) in B16 melanoma cells:production of RD ⁃ pheomelanin and covalent binding with thiolproteins[J]. Pigment Cell Melanoma Res, 2015,28(3):295⁃306.doi: 10.1111/pcmr.12363.
[6] Hayashi M, Okamura K, Abe Y, et al. Janus kinase inhibitortofacitinib does not facilitate the repigmentation in mouse modelof rhododendrol ⁃ induced vitiligo[J]. J Dermatol, 2019,46(6):548⁃550. doi: 10.1111/1346⁃8138.14879.
[7] Tsutsumi R, Sugita K, Abe Y, et al. Leukoderma induced byrhododendrol is different from leukoderma of vitiligo inpathogenesis: a novel comparative morphological study[J]. JCutan Pathol, 2019,46(2):123⁃129. doi: 10.1111/cup.13396.
[8] Zhu Y, Wang S, Xu A. A mouse model of vitiligo induced bymonobenzone[J]. Exp Dermatol, 2013,22(7):499 ⁃ 501. doi:10.1111/exd.12184.
[9] van den Boorn JG, Konijnenberg D, Tjin EP, et al. Effectivemelanoma immunotherapy in mice by the skin ⁃ depigmentingagent monobenzone and the adjuvants imiquimod and CpG[J/OL]. PLoS One, 2010,5(5):e10626. doi: 10.1371/journal.pone.0010626.
[10] Westerhof W, Manini P, Napolitano A, et al. The haptenationtheory of vitiligo and melanoma rejection: a close ⁃ up[J]. ExpDermatol, 2011,20(2):92 ⁃ 96. doi: 10.1111/j.1600 ⁃ 0625.2010.01200.x.
[11] van den Boorn JG, Melief CJ, Luiten RM. Monobenzone⁃induceddepigmentation: from enzymatic blockade to autoimmunity[J].Pigment Cell Melanoma Res, 2011,24(4):673⁃679. doi: 10.1111/j.1755⁃148X.2011.00878.x.
[12] van den Boorn JG, Picavet DI, van Swieten PF, et al. Skin ⁃depigmenting agent monobenzone induces potent T ⁃ cellautoimmunity toward pigmented cells by tyrosinase haptenationand melanosome autophagy[J]. J Invest Dermatol, 2011,131(6):1240⁃1251. doi: 10.1038/jid.2011.16.
[13] Overwijk WW, Theoret MR, Finkelstein SE, et al. Tumorregression and autoimmunity after reversal of a functionally tolerant state of self⁃reactive CD8+ T cells[J]. J Exp Med, 2003,198(4):569⁃580. doi: 10.1084/jem.20030590.
[14] Harris JE. Chemical⁃induced vitiligo[J]. Dermatol Clin, 2017,35(2):151⁃161. doi: 10.1016/j.det.2016.11.006.
[15] Mansourpour H, Ziari K, Motamedi SK, et al. Therapeutic effectsof iNOS inhibition against vitiligo in an animal model[J]. Eur JTransl Myol, 2019,29(3):8383. doi: 10.4081/ejtm.2019.8383.
[16] 祝逸平, 王遂泉, 李阳, 等. 局部针刺对莫诺苯宗诱导C57BL/6 小鼠白癜风样模型的影响[J]. 中华皮肤科杂志, 2014,47(1):26⁃29. doi: 10.3760/cma.j.issn.0412⁃4030.2014.01.008.
[17] 李情, 祝逸平, 许爱娥. 茶多酚、吡美莫司、他克莫司外用对莫诺苯宗诱导白癜风样模型小鼠的疗效比较[J]. 中华皮肤科杂志, 2015,48(1):41 ⁃ 44. doi: 10.3760/cma.j.issn.0412 ⁃ 4030.2015.01.014.
[18] Finkelstein SE, Heimann DM, Klebanoff CA, et al. Bedside tobench and back again: how animal models are guiding thedevelopment of new immunotherapies for cancer[J]. J LeukocBiol, 2004,76(2):333⁃337. doi: 10.1189/jlb.0304120.
[19] Overwijk WW, Tsung A, Irvine KR, et al. gp100/pmel 17 is amurine tumor rejection antigen: induction of "self" ⁃ reactive,tumoricidal T cells using high ⁃ affinity, altered peptide ligand[J]. J Exp Med, 1998,188(2):277 ⁃ 286. doi: 10.1084/jem.188. 2.277.
[20] Klebanoff CA, Finkelstein SE, Surman DR, et al. IL ⁃ 15enhances the in vivo antitumor activity of tumor⁃reactive CD8+ Tcells[J]. Proc Natl Acad Sci U S A, 2004,101(7):1969⁃1974.doi: 10.1073/pnas.0307298101.
[21]Riding RL, Richmond JM, Harris JE. Mouse model for humanvitiligo[J]. Curr Protoc Immunol, 2019,124(1):e63. doi: 10.1002/cpim.63.
[22] Grichnik JM, Burch JA, Burchette J, et al. The SCF/KITpathway plays a critical role in the control of normal humanmelanocyte homeostasis[J]. J Invest Dermatol, 1998,111(2):233⁃238. doi: 10.1046/j.1523⁃1747.1998.00272.x.
[23] Wehrle ⁃ Haller B. The role of Kit ⁃ ligand in melanocytedevelopment and epidermal homeostasis[J]. Pigment Cell Res,2003,16(3):287⁃296. doi: 10.1034/j.1600⁃0749.2003.00055.x.
[24] Nishimura EK, Jordan SA, Oshima H, et al. Dominant role of theniche in melanocyte stem ⁃ cell fate determination[J]. Nature,2002,416(6883):854⁃860. doi: 10.1038/416854a.
[25] Nishimura EK, Yoshida H, Kunisada T, et al. Regulation of E ⁃and P⁃cadherin expression correlated with melanocyte migrationand diversification[J]. Dev Biol, 1999,215(2):155 ⁃ 166. doi:10.1006/dbio.1999.9478.
[26] Lo JA, Kawakubo M, Juneja VR, et al. Epitope spreading towardwild ⁃ type melanocyte ⁃ lineage antigens rescues suboptimal immune checkpoint blockade responses[J]. Sci Transl Med,2021,13(581): eabd8636. doi: 10.1126/scitranslmed.abd8636.
[27] Hua C, Boussemart L, Mateus C, et al. Association of vitiligo with tumor response in patients with metastatic melanomatreated with pembrolizumab[J]. JAMA Dermatol, 2016,152(1):45⁃51. doi: 10.1001/jamadermatol.2015.2707.
[28] Herzberg B, Fisher DE. Metastatic melanoma andimmunotherapy[J]. Clin Immunol, 2016,172:105 ⁃ 110. doi: 10.1016/j.clim.2016.07.006.
[29] Turk MJ, Guevara ⁃ Patiño JA, Rizzuto GA, et al. Concomitanttumor immunity to a poorly immunogenic melanoma is preventedby regulatory T cells[J]. J Exp Med, 2004,200(6):771⁃782. doi:10.1084/jem.20041130.
[30] Xu Z, Chen D, Hu Y, et al. Anatomically distinct fibroblastsubsets determine skin autoimmune patterns[J]. Nature, 2022,601(7891):118⁃124. doi: 10.1038/s41586⁃021⁃04221⁃8.
[31] Halprin KM. Epidermal "turnover time" ⁃ ⁃a re ⁃examination[J].Br J Dermatol, 1972,86(1):14 ⁃ 19. doi: 10.1111/j.1365 ⁃ 2133.1972.tb01886.x.
[32] Gregg RK, Nichols L, Chen Y, et al. Mechanisms of spatial andtemporal development of autoimmune vitiligo in tyrosinase ⁃specific TCR transgenic mice[J]. J Immunol, 2010,184(4):1909⁃1917. doi: 10.4049/jimmunol.0902778.
[33] Nichols LA, Chen Y, Colella TA, et al. Deletional self⁃toleranceto a melanocyte/melanoma antigen derived from tyrosinase ismediated by a radio ⁃ resistant cell in peripheral and mesentericlymph nodes[J]. J Immunol, 2007,179(2):993 ⁃ 1003. doi: 10.4049/jimmunol.179.2.993.
[34] Eby JM, Kang HK, Klarquist J, et al. Immune responses in amouse model of vitiligo with spontaneous epidermal de ⁃ andrepigmentation[J]. Pigment Cell Melanoma Res, 2014,27(6):1075⁃1085. doi: 10.1111/pcmr.12284.
[35] Eby JM, Kang HK, Tully ST, et al. CCL22 to activate Tregmigration and suppress depigmentation in vitiligo[J]. J InvestDermatol, 2015,135(6):1574⁃1580. doi: 10.1038/jid.2015.26.
[36] Mehrotra S, Al ⁃ Khami AA, Klarquist J, et al. A coreceptor ⁃independent transgenic human TCR mediates anti ⁃ tumor andanti ⁃self immunity in mice[J]. J Immunol, 2012,189(4):1627⁃1638. doi: 10.4049/jimmunol.1103271.
[37] Oyarbide ⁃ Valencia K, van den Boorn JG, Denman CJ, et al.Therapeutic implications of autoimmune vitiligo T cells[J].Autoimmun Rev, 2006,5(7):486⁃492. doi: 10.1016/j.autrev.2006.03.012.
[38] Wang S, Zhou M, Lin F, et al. Interferon ⁃γ induces senescencein normal human melanocytes[J/OL]. PLoS One, 2014,9(3): e93232. doi: 10.1371/journal.pone.0093232.
[39] Dell′anna ML, Cario⁃André M, Bellei B, et al. In vitro researchon vitiligo: strategies, principles, methodological options andcommon pitfalls[J]. Exp Dermatol, 2012,21(7):490 ⁃ 496. doi:10.1111/j.1600⁃0625.2012.01506.x.